- 发布日期:2024-12-12 20:12 点击次数:107

关于刻下仍涉及民众的 COVID-19,多数接头信息,如病毒的作用受体及联结位点、作用机制通过接头仍是掌持;必要的接头及检测器具也在短期内得到诞生;易理性接头和诞生符合的动物接头模子也在多种属动物体内进行猫色网,如雪狗尾续、仓鼠、猫、犬、貉、兔、转基因鼠、猪、猴、禽类及果蝠等。 在进行病毒 RNA 侵袭部位的接头中,发现不同种属间存在一定的诀别,如病毒更偏疼感染雪狗尾续的上呼吸说念(Upper Respiratory Track, URT), 西伯利亚仓鼠的下呼吸说念更容易受到感染,而东说念主偏激他非东说念主灵长类的迤逦呼吸说念王人是病毒的侵袭部位。到当今适度,险些统共对病毒感染部位的检测和分析王人是通过对 FFPE 切片进行传统免疫组织化学 (IHC) 的看成开展的。可是这种仅基于多少组织切片、而冷落举座组织空间配景的看成,所得信息具有严重东说念主为偏碍、论断单方面化的不及是了然于目的。 近来,跟着组织透明化本事(Tissue Optical Clearing,TOC)的熟练,愚弄该本事进行病毒感染关系接头已有多篇报说念,阐述 TOC 在接头中的上风也越来越取得剖析 [1-6]。针对刻下仍在民众规模内涉及的 SARS-CoV-2 病毒,也有遴荐 3D 举座成像,将病毒感染可视化的接头文件发表 [7,8]。值得一提的是,鼻腔内存在骨质化的鼻甲结构,在遴荐 ECi(Ethyl cinnamate)的透明化有贪图后亦呈现光学透明化,满足光片举座成像对样本的质料条目。
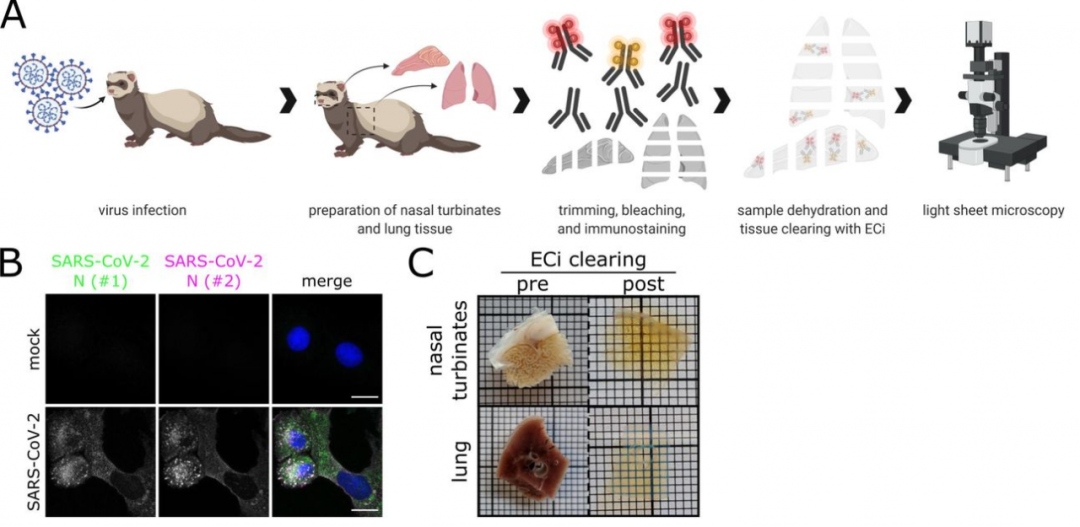 施行经由如图所示,对雪狗尾续进行鼻腔感染。4 天后获取贪图组织后,固定、免疫象征并遴荐 ECi 透明化后,对组织块进行光片 3D 举座成像。
施行经由如图所示,对雪狗尾续进行鼻腔感染。4 天后获取贪图组织后,固定、免疫象征并遴荐 ECi 透明化后,对组织块进行光片 3D 举座成像。
在厚度约为 4-mm 的上呼吸说念样本中,在鼻甲腹侧和背侧多处贪图区域均可见 SARS-CoV-2 感染 (如下图 2B)。 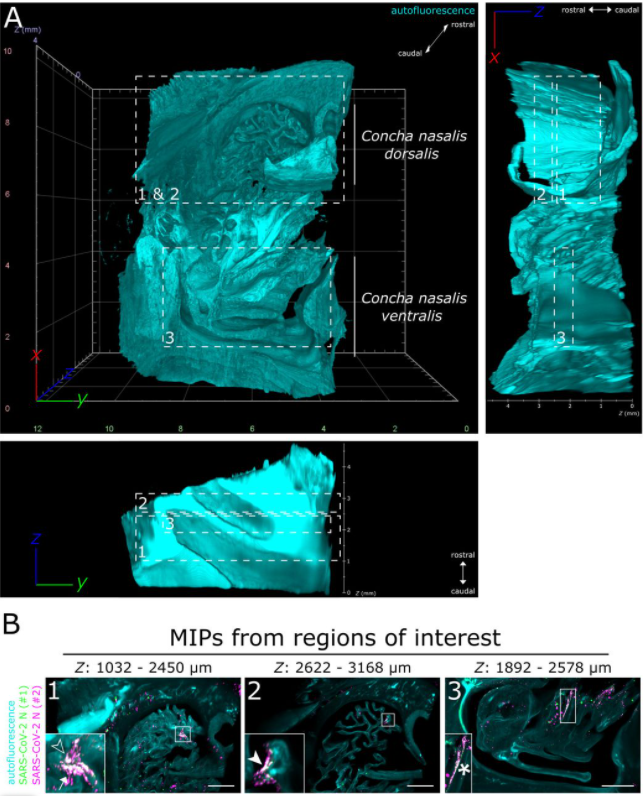
使用光片举座成像将鼻甲部位 SARS-CoV-2 感染的三维空间分散可视化。(A) 鼻甲组织结构 (> 200 mm3,感染 4 天后取材) 网格边线透露长度为 2 mm (B) 对贪图区域内病毒含量进行强度投射,绿色和玫红色分袂为不同起首商品化 SARS-CoV 病毒 N 卵白。标尺 = 1 mm。 在光片成像为获取病毒三维空间分散的宏不雅数据的基础上,借助共聚焦扫描成像以亚细胞分辨率潜入了解,可见 SARS- CoV-2 胞内段 N 卵白在纤毛细胞和非纤毛细胞内均有存在,并主要在纤毛细胞的顶端酿成联结。 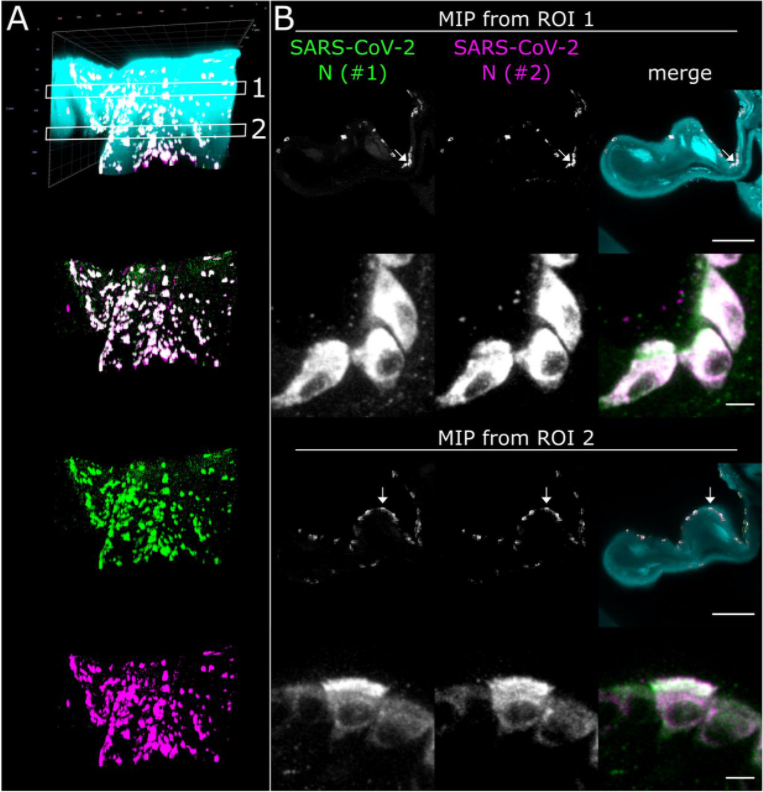
(A) 对贪图区域 1(ROI 1)中 SARS-CoV-2 感染强度作念投射。图像遴荐 40x/1.1 水浸物镜进行收罗。青绿色为样本自觉荧光; 绿色象征为 SARS-CoV-2(N 卵白 1); 玫红色 = SARS-CoV-2(N 卵白 #2)。标尺分袂为 100 µm (宏不雅) 和 5 µm (细部)。 好意思天旎光片成像责罚有贪图 好意思天旎 UltraMicroscope 光片显微镜系列遴荐刻下先进的光片光学系统和成像分析软件,提供针对完竣器官大样本特别的三维立体成像体验,透明化的整只小鼠样本亦不在话下;更有自动化高通量竖立,撑持多至 5 个样本、多个放大倍率间摆脱切换且自动聚焦,令图像弥远保持机敏边际的高品性成像,满足后续复杂图像数据分析。 好意思天旎 MACS Clearing Kit (130-126-719) 是基于 ECi 的高效、易用型组织透明化试剂盒,一种试剂盒满足东说念主和小鼠险些统共组织器官的透明化处理,经由浅易安全无毒;包含的免疫象征缓冲液保证充分的抗体浸润和联结。 本文即遴荐 ECi 的组织透明化看成并使用 UltraMicroscope 进行成像,发表于 2020 年 10 月。文件标题为:3D reconstruction of SARS-CoV-2 infection in ferrets emphasizes focal infection pattern in the upper respiratory tract。 好意思天旎 REAfinity 成像用重组抗体经过优化和考证,径直偶联荧光象征物省去二抗象征和相应非特异象征的烦嚣,专用于相识且高信噪比的组织三维免疫象征。 参考文件:
【1】Potratz, M.; Zaeck, L.; Christen, M.; Te Kamp, V.; Klein, A.; Nolden, T.; Freuling, C.M.; Muller, T.; Finke, S. Astrocyte Infection during Rabies Encephalitis Depends on the Virus Strain and Infection Route as Demonstrated by Novel Quantitative 3D Analysis of Cell Tropism. Cells 2020, doi:10.3390/cells9020412.
探花视频【2】Zaeck, L.; Potratz, M.; Freuling, C.M.; Muller, T.; Finke, S. High-Resolution 3D Imaging of Rabies Virus Infection in Solvent-Cleared Brain Tissue. J Vis Exp 2019, 10.3791/59402, doi:10.3791/59402.
【3】Kieffer, C.; Ladinsky, M.S.; Ninh, A.; Galimidi, R.P.; Bjorkman, P.J. Longitudinal imaging of HIV-1 spread in humanized mice with parallel 3D immunofluorescence and electron tomography. Elife 2017, 6, doi:10.7554/eLife.23282.
【4】Potratz, M.; Zaeck, L.M.; Weigel, C.; Klein, A.; Freuling, C.M.; Müller, T.; Finke, S. Neuroglia Infection by Rabies Virus after Anterograde Virus Spread in Peripheral Neurons. bioRxiv 2020, 10.1101/2020.09.20.305078, doi:10.1101/2020.09.20.305078.
【5】Ladinsky, M.S.; Khamaikawin, W.; Jung, Y.; Lin, S.; Lam, J.; An, D.S.; Bjorkman, P.J.; Kieffer, C. Mechanisms of virus dissemination in bone marrow of HIV-1-infected humanized BLT mice. Elife 2019, 8, doi:10.7554/eLife.46916.
【6】Chhatbar, C.; Detje, C.N.; Grabski, E.; Borst, K.; Spanier, J.; Ghita, L.; Elliott, D.A.; Jordao, M.J.C.; Mueller, N.; Sutton, J., et al. Type I Interferon Receptor Signaling of Neurons and Astrocytes Regulates Microglia Activation during Viral Encephalitis. Cell Rep 2018, 25, 118-129 e114, doi:10.1016/j.celrep.2018.09.003.
【7】Eckermann, M.; Frohn, J.; Reichardt, M.; Osterhoff, M.; Sprung, M.; Westermeier, F.; Tzankov, A.; Werlein, C.; Kuhnel, M.; Jonigk, D., et al. 3D virtual pathohistology of lung tissue from Covid-19 patients based on phase contrast X-ray tomography. Elife 2020, 9, doi:10.7554/eLife.60408.
【8】Li, G.; Fox, S.E.; Summa, B.; Hu, B.; Wenk, C.; Akmatbekov, A.; Harbert猫色网, J.L.; Vander Heide, R.S.; Brown, J.Q. Multiscale 3-dimensional pathology findings of COVID-19 diseased lung using high-resolution cleared tissue microscopy.

